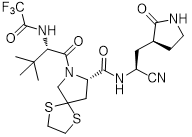
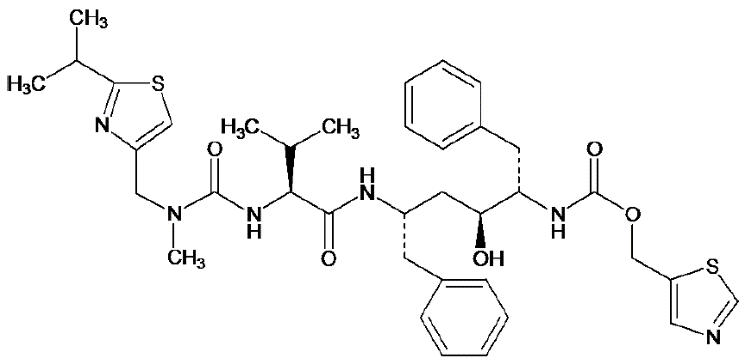
药代动力学
已在健康受试者中开展了先诺特韦/利托那韦的药代动力学研究。利托那韦为CYP3A4抑制剂,与先诺特韦联用后可增加先诺特韦的全身暴露。
1. 吸收
健康受试者多次空腹口服先诺特韦片0.750g首次给药后 Cmax、AUC0-12h、AUC0-∞的算数均值分别为1035 ng /mL、3773 ng•h/mL、4073 ng•h/mL,半衰期T1/2约为3.1h,中位Tmax为 1.75h;健康受试者单次空腹口服先诺特韦片/利托那韦片 0.750g/0.1g后Cmax、AUC0-12h、AUC0-∞的算数均值分别为5365
ng /mL、30354 ng•h/mL、35515 ng•h/mL,半衰期T1/2约为4.1h,中位Tmax为 3.00h(表1);先诺特韦联用利托那韦后相较于先诺特韦单药给药,先诺特韦暴露量显著增加。先诺特韦片/利托那韦片 0.750g/0.1g单次给药的暴露量Cmax、AUC0-12h和 AUC0-∞分别约为先诺特韦片750mg单药单次给药后的5.2倍,8.0倍和8.7倍。
表1 先诺特韦药代动力学参数
| 参数 |
先诺特韦片 0.750g (N=6)* |
先诺特韦片/利托那韦片 0.750g/0.1g (N=6)# |
| AUC0-∞ (h·ng/mL) |
4073 (2138) |
35515 (5663) |
| AUC0-12h (h·ng/mL) |
3773 (2111) |
30354 (5578) |
| Cmax(ng/mL) |
1035 (562) |
5365 (885) |
| T1/2 (h) |
3.10 (0.843) |
4.14 (0.75) |
| Tmax (h) |
1.75 (1.00-3.00) |
3.00 (0.50 - 6.00) |
注释:*先诺特韦单药多次给药后首次给药的数据,#先诺特韦片/利托那韦片联合单次给药的数据,表数据为算数均值(标准差),其中Tmax 为中位数(范围)。
健康受试者单次空腹口服先诺特韦片/利托那韦片0.25g/0.1g~1.2g/0.1g,先诺特韦的暴露量随剂增加呈剂量依赖性增加,在0.25g~0.75g的剂量范围内,Cmax增加比例小于剂量增加比例,AUC增加比例与剂量增加比例基本一致,在0.75g~1.2g剂量范围内,暴露增加比例小于剂量增加比例。多次口服先诺特韦片/利托那韦片0.15g/0.1g ~0.75g/0.1g,先诺特韦暴露的增加比例小于剂量增加比例,先诺特韦在第3天给药前达到稳态,第6天较第1天C
max、AUCtau蓄积指数分别为1.28和1.39。
2. 食物对口服吸收的影响
与空腹服药相比,高脂餐和普通餐后服用先诺特韦片/利托那韦片对AUC和Cmax有相似的影响,其中Cmax升高约70%,AUC升高约50%。(表2)。
表2 空腹和餐后状态下先诺特韦药代动力学参数
| 参数 |
先诺特韦片/利托那韦片 0.750g/0.1g
(空腹)
N=24) |
先诺特韦片/利托那韦片 0.750g/0.1g
(普通餐)
(N=12) |
先诺特韦片/利托那韦片 0.750g/0.1g
(高脂餐)
(N=12) |
| AUC0-∞ (h·ng/mL) |
32383(26.2%) |
45957(20.9%) |
46810(14.9%) |
| AUC0-t (h·ng/mL) |
32159(26.5%) |
45736(21.0%) |
46598(14.8%) |
| Cmax(ng/mL) |
4954(19.2%) |
8485(16.9%) |
8845(18.1%) |
| t1/2 (h) |
4.57±1.29 |
3.00±0.386 |
2.86±0.291 |
| Tmax (h) |
2.00(0.500~4.00) |
3.00(1.00~4.00) |
2.00(1.00~4.00) |
表中数据为算术平均值(%CV),其中Tmax为中位数(范围),t1/2 为算术平均值±SD。
3. 分布
健康受试者单次空腹口服先诺特韦片/利托那韦片0.750g/0.1g后,先诺特韦的表观分布容积约为138L。先诺特韦与人的平均血浆蛋白结合率约为72.5%。先诺特韦在人全血中的全血血浆分配没有明显浓度依赖性,在血红细胞和血浆中接近均等分布。
单次服用600mg后利托那韦的表观分布容积(Vß/F)约为20-40升。利托那韦在人血浆中的蛋白结合率约为98~99%。
4. 代谢
体外研究表明,先诺特韦是P-gp、CYP3A的底物,不是OATP1B1、OATP1B3、OAT1、OAT3、OCT2、MATE1和MATE2-K的底物。先诺特韦主要由CYP3A酶代谢。
在临床相关浓度下,先诺特韦对CYP3A4/5存在时间依赖性抑制,对其他主要的CYP450酶(CYP1A2、CYP2B6、CYP2C8、CYP2C9、CYP2C19、CYP2D6)未表现出明显的抑制作用。先诺特韦对CYP1A2无诱导作用;1.0 μM的先诺特韦对CYP2B6和CYP3A4无诱导作用,10.0~100 μM的先诺特韦对CYP2B6和CYP3A4有一定的诱导作用。
先诺特韦对OATP1B1、OATP1B3和OAT3存在较弱抑制,对P-gp、BCRP、OAT1、OCT2、MATE1和MATE2-K基本无抑制作用。
利托那韦对 CYP3A 具有抑制作用,对 CYP2D6 的抑制作用弱于 CYP3A。利托那韦主要是 CYP3A 的底物,同时也是 CYP2D6的底物,CYP2D6 参与了异丙噻唑氧化代谢物(M-2)的形成。
利托那韦与先诺特韦联用时,能够抑制先诺特韦的代谢。先诺特韦在血浆中主要以原型存在,没有高比例代谢产物(大于1%)。先诺特韦在尿液中以原型药物为主,代谢产物的含量均较低。粪便中以原型药物和酰胺水解代谢物、氰基氧化(或内酰胺氧化开环)代谢物为主,其余代谢产物的含量均较低。
5. 排泄
与利托那韦联用时,先诺特韦主要以原型经尿液排泄。健康受试者单次口服先诺特韦片/利托那韦片0.750g/0.1g后,先诺特韦相关物质的累积排泄率为92.1%,其中尿液中回收55.4% ,粪便中回收36.7%。
使用14C放射性同位素标记的利托那韦人体研究显示利托那韦主要经肝胆系统清除。粪便中可回收大约 86%的放射性同位素标记物,包括部分未被吸收的利托那韦。
6. 特殊人群
年龄、体重、性别
尚未考察年龄、体重、性别对先诺特韦/利托那韦药代动力学的影响。
群体药动学分析结果显示,年龄,性别,体重对先诺特韦的药代动力学参数均无临床显著性影响。
儿科人群
尚未在18岁以下患者中开展临床研究。
肾损伤患者
尚未获得肾功能损伤受试者的药代动力学数据。
肝损伤患者
尚未获得肝功能损伤受试者的药代动力学数据。