
适应症+用法用量
- 适 应 症 :
- 用于治疗轻中度新型冠状病毒感染(COVID-19)的成年患者。
目前病毒仍在不断变异,本品应根据新冠病毒流行株变异情况,进行相应研究,确认其对于当前流行株的有效性。
- 用法用量:
-
(1) 方法:口服,空腹给药。片剂需整片吞服,不得咀嚼、掰开或压碎。本品为先诺特韦片与利托那韦片的组合包装。先诺特韦必须与利托那韦同服。如不与利托那韦同服,先诺特韦的血浆水平可能不足以达到所需的治疗效果。应在首次出现症状3天或以内尽快使用。
(2) 剂量:推荐剂量为先诺特韦0.750g(2片)联用利托那韦0.1g(1片),每12小时一次口服给药,连续服用5天。
(3) 过量:本品暂无药物过量相关研究数据。如果发生药物过量,相关治疗应包括一般支持性措施(包括监测生命体征和观察患者的临床状态等)。本品用药过量没有特效解毒剂。 - 特殊人群
-
老年患者
老年患者无需调整剂量(伴有肝肾功能不全的老年患者,参见肝肾功能不全人群的使用方法)。
肝功能不全
轻度肝功能不全患者(Child Pugh A级)或者中度肝功能不全患者(Child Pugh B级)无需调整本品剂量。重度肝功能不全患者不应使用本品。
肾功能不全
轻度肾功能不全患者(eGFR ≥ 60 至 <90 mL/min)无需调整剂量。
在中度肾功能不全患者(eGFR ≥ 30 至 <60 mL/min)中,应将本品的剂量减少至先诺特韦/利托那韦0.375g/0.1g,每12小时一次,连续5天,以避免过度暴露。
重度肾功能不全患者(eGFR <30 mL/min)不应使用本品,包括血液透析下的终末期肾病(ESRD)患者。
作用机制
先诺特韦是一种SARS-CoV-2主要蛋白酶Mpro(也称为3C-样蛋白酶,3CLpro)的拟肽类抑制剂,抑制SARS-CoV-2 Mpro可使其无法加工多蛋白前体,从而阻止病毒复制。
利托那韦抑制CYP3A介导的先诺特韦代谢,从而升高先诺特韦血药浓度。
成份
本品为先诺特韦片和利托那韦片组合包装。
先诺特韦片活性成份为先诺特韦。
化学名称:(S)-N-((S)-1-氰基-2-((S)-2-氧代-3-吡咯烷基)乙基)-7-((S)-3,3-二甲基-2-(2,2,2-三氟乙酰氨基)丁酰基)-1,4-二硫杂-7-氮杂螺[4.4]壬烷-8-甲酰胺
化学结构式:
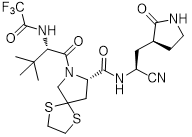
分子式:C22H30F3N5O4S2
分子量:549.63
辅料:微晶纤维素、乳糖一水合物、交联羧甲纤维素钠、胶态二氧化硅、硬脂富马酸钠、薄膜包衣预混剂(胃溶型)(羟丙甲纤维素、二氧化钛、聚乙二醇、红氧化铁)
利托那韦片活性成份为利托那韦。
化学名称:5-噻唑甲基[(αS)-α-[(1S,3S)-1-羟基-3-[(2S)-2-[3-[(2-异丙基-4-噻唑)甲基]-3-甲基脲]-3-甲基丁基酰胺]-4-苯基丁烷]苯乙基]氨基甲酸酯
化学结构式:
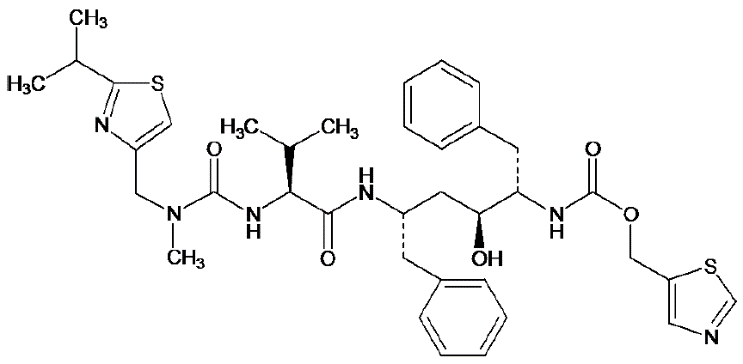
分子式:C37H48N6O5S2
分子量:720.94
辅料:共聚维酮、胶态二氧化硅、月桂山梨坦、无水磷酸氢钙、硬脂富马酸钠、胃溶型薄膜包衣粉(羟丙甲纤维素、羟丙纤维素、聚乙二醇、滑石粉、聚山梨酯、二氧化硅、二氧化钛)。
为什么选择3CLpro作为药物靶点?
-
1
3CLpro是SARS-CoV-2的一种功能蛋白,在病毒复制周期中具有重要作用1,2:SARS-CoV-2进入宿主细胞后,RNA(+)基因组迅速翻译出两种多聚蛋白,随后这两种多聚蛋白被病毒编码的两种蛋白酶裂解成16种功能蛋白;而这两种蛋白酶之一即为3CLpro(也称主要蛋白酶Mpro)。 -
2
所有冠状病毒的3CLpro结构与功能都是高度保守的,SARS-CoV-1和SARS-CoV-2的3CLpro序列同源性约为96%。所以,靶向3CLpro的药物具有广谱抗冠状病毒潜力,并且降低潜在新病毒株耐药相关突变的可能性3,4。 -
3
3CLpro独特的识别序列与任何已知的人类蛋白酶无相关性,其靶向药物具有高选择性和低副作用的潜力5,6。
Ref:
1) Rolf Hilgenfeld. FEBS J, 2014, 281(18): 4085–4096.
2) Linlin Zhang, et al. Science, 2020, 368(6489): 409–412.
3) Milligan, et al. Biochem J, 2021, 478(13): 2499–2515.
4) Bhupesh Goyal, et al. ACS Comb Sci, 2020 , 22(6): 297-305.
5) Dafydd R Owen, et al. Science, 2021, 374(6575): 1586-1593.
6) Britton Boras, et al. bioRxiv, 2020.09.12.293498.
药效学
心脏电生理学
先诺特韦单药单次/多次给药在150mg~3000mg剂量水平下或联合利托那韦单次/多次给药在150mg~1200mg剂量水平下,平均Cmax所对应的模型预测的ΔΔQTcF的双侧 90%CI上限均低于10 ms。基于模型预测,先诺特韦750mg BID剂量联合利托那韦给药,最高8倍平均Cmax所对应的ΔΔQTcF的双侧 90%CI上限低于10 ms。
药代动力学
已在健康受试者中开展了先诺特韦/利托那韦的药代动力学研究。利托那韦为CYP3A4抑制剂,与先诺特韦联用后可增加先诺特韦的全身暴露。
1. 吸收
健康受试者多次空腹口服先诺特韦片0.750g首次给药后 Cmax、AUC0-12h、AUC0-∞的算数均值分别为1035 ng /mL、3773 ng•h/mL、4073 ng•h/mL,半衰期T1/2约为3.1h,中位Tmax为 1.75h;健康受试者单次空腹口服先诺特韦片/利托那韦片 0.750g/0.1g后Cmax、AUC0-12h、AUC0-∞的算数均值分别为5365 ng /mL、30354 ng•h/mL、35515 ng•h/mL,半衰期T1/2约为4.1h,中位Tmax为 3.00h(表1);先诺特韦联用利托那韦后相较于先诺特韦单药给药,先诺特韦暴露量显著增加。先诺特韦片/利托那韦片 0.750g/0.1g单次给药的暴露量Cmax、AUC0-12h和 AUC0-∞分别约为先诺特韦片0.750g单药单次给药后的5.2倍,8.0倍和8.7倍。
表1 先诺特韦药代动力学参数
| 参数 | 先诺特韦片 0.750g (N=6)* | 先诺特韦片/利托那韦片 0.750g/0.1g (N=6)# |
| AUC0-∞ (h·ng/mL) | 4073 (2138) | 35515 (5663) |
| AUC0-12h (h·ng/mL) | 3773 (2111) | 30354 (5578) |
| Cmax(ng/mL) | 1035 (562) | 5365 (885) |
| T1/2 (h) | 3.10 (0.843) | 4.14 (0.75) |
| Tmax (h) | 1.75 (1.00-3.00) | 3.00 (0.50 - 6.00) |
注释:*先诺特韦单药多次给药后首次给药的数据,#先诺特韦片/利托那韦片联合单次给药的数据,表数据为算数均值(标准差),其中Tmax 为中位数(范围)。
健康受试者单次空腹口服先诺特韦片/利托那韦片0.25g/0.1g~1.2g/0.1g,先诺特韦的暴露量随剂增加呈剂量依赖性增加,在0.25g~0.75g的剂量范围内,Cmax增加比例小于剂量增加比例,AUC增加比例与剂量增加比例基本一致,在0.75g~1.2g剂量范围内,暴露增加比例小于剂量增加比例。多次口服先诺特韦片/利托那韦片0.15g/0.1g ~0.75g/0.1g,先诺特韦暴露的增加比例小于剂量增加比例,先诺特韦在第3天给药前达到稳态,第6天较第1天C max、AUCtau蓄积指数分别为1.28和1.39。
2. 食物对口服吸收的影响
与空腹服药相比,高脂餐和普通餐后服用先诺特韦片/利托那韦片对AUC和Cmax有相似的影响,其中Cmax升高约70%,AUC升高约50%。(表2)。
表2 空腹和餐后状态下先诺特韦药代动力学参数
| 参数 | 先诺特韦片/利托那韦片 0.750g/0.1g
(空腹) N=24) |
先诺特韦片/利托那韦片 0.750g/0.1g
(普通餐) (N=12) |
先诺特韦片/利托那韦片 0.750g/0.1g
(高脂餐) (N=12) |
| AUC0-∞ (h·ng/mL) | 32383(26.2%) | 45957(20.9%) | 46810(14.9%) |
| AUC0-t (h·ng/mL) | 32159(26.5%) | 45736(21.0%) | 46598(14.8%) |
| Cmax(ng/mL) | 4954(19.2%) | 8485(16.9%) | 8845(18.1%) |
| t1/2 (h) | 4.57±1.29 | 3.00±0.386 | 2.86±0.291 |
| Tmax (h) | 2.00(0.500~4.00) | 3.00(1.00~4.00) | 2.00(1.00~4.00) |
表中数据为算术平均值(%CV),其中 Tmax 为中位数(范围),t1/2 为算术平均值±SD。
3. 分布
健康受试者单次空腹口服先诺特韦片/利托那韦片0.750g/0.1g后,先诺特韦的表观分布容积约为138L。先诺特韦与人的平均血浆蛋白结合率约为72.5%。先诺特韦在人全血中的全血血浆分配没有明显浓度依赖性,在血红细胞和血浆中接近均等分布。
单次服用600mg后利托那韦的表观分布容积(Vß/F)约为20-40升。利托那韦在人血浆中的蛋白结合率约为98~99%。
4. 代谢
体外研究表明,先诺特韦是P-gp、CYP3A的底物,不是OATP1B1、OATP1B3、OAT1、OAT3、OCT2、MATE1和MATE2-K的底物。先诺特韦主要由CYP3A酶代谢。
在临床相关浓度下,先诺特韦对CYP3A4/5存在时间依赖性抑制,对其他主要的CYP450酶(CYP1A2、CYP2B6、CYP2C8、CYP2C9、CYP2C19、CYP2D6)未表现出明显的抑制作用。先诺特韦对CYP1A2无诱导作用;1.0 μM的先诺特韦对CYP2B6和CYP3A4无诱导作用,10.0~100 μM的先诺特韦对CYP2B6和CYP3A4有一定的诱导作用。
先诺特韦对OATP1B1、OATP1B3和OAT3存在较弱抑制,对P-gp、BCRP、OAT1、OCT2、MATE1和MATE2-K基本无抑制作用。
利托那韦对 CYP3A 具有抑制作用,对 CYP2D6 的抑制作用弱于 CYP3A。利托那韦主要是 CYP3A 的底物,同时也是 CYP2D6的底物,CYP2D6 参与了异丙噻唑氧化代谢物(M-2)的形成。
利托那韦与先诺特韦联用时,能够抑制先诺特韦的代谢。先诺特韦在血浆中主要以原型存在,没有高比例代谢产物(大于1%)。先诺特韦在尿液中以原型药物为主,代谢产物的含量均较低。粪便中以原型药物和酰胺水解代谢物、氰基氧化(或内酰胺氧化开环)代谢物为主,其余代谢产物的含量均较低。
5. 排泄
与利托那韦联用时,先诺特韦主要以原型经尿液排泄。健康受试者单次口服先诺特韦片/利托那韦片0.750g/0.1g后,先诺特韦相关物质的累积排泄率为92.1%,其中尿液中回收55.4% ,粪便中回收36.7%。
使用14C放射性同位素标记的利托那韦人体研究显示利托那韦主要经肝胆系统清除。粪便中可回收大约 86%的放射性同位素标记物,包括部分未被吸收的利托那韦。
6. 特殊人群
年龄、体重、性别
尚未考察体重、性别对先诺特韦/利托那韦药代动力学的影响。
群体药动学分析结果显示,年龄,性别,体重对先诺特韦的药代动力学参数均无临床显著性影响。
在健康老年人受试者中开展的临床药代动力学研究(SIM0417-108)中,单次空腹口服先诺特韦/利托那韦0.750g/0.1g后,与I期临床研究(B02B11101-101研究)中健康成年人受试者相比,健康老年人受试者的血浆中先诺特韦的暴露(AUC0-∞、Cmax)与健康成年受试者的暴露相当。
儿科人群
尚未在18岁以下患者中开展临床研究。
肾损伤患者
尚未在重度肾功能不全受试者中开展临床研究。在轻度、中度肾功能不全受试者中,先诺特韦的暴露量随着肾功能不全严重程度的增加而增加。
单次空腹口服先诺特韦/利托那韦0.6g/0.1g后,与正常肾功能受试者相比,轻度肾功能不全(eGFR ≥ 60 至 <90 mL/min )受试者的AUC0-t增加约14.1%,Cmax降低约2.2%。单次空腹口服先诺特韦/利托那韦0.375g/0.1g后,与正常肾功能受试者相比,中度肾功能不全(eGFR ≥ 30 至 <60 mL/min)受试者的AUC0-t增加约123.1%,Cmax增加约61.9%。先诺特韦的血浆蛋白结合率在轻度、中度肾功能不全受试者中与正常肾功能受试者的相当。
表3 轻度肾功能不全和正常肾功能状态下先诺特韦药代动力学参数
| 参数 | 正常肾功能(N=6) | 轻度肾功能不全(N=6) |
| AUC0-∞ (h·ng/mL) | 28046(12.9%) | 32065 (36.1%) |
| AUC0-t (h·ng/mL) | 27976 (13.0%) | 31917 (36.4%) |
| Cmax(ng/mL) | 4518(18.5%) | 4419(45.1%) |
| t1/2 (h) | 4.72±0.94 | 4.43±1.22 |
| Tmax (h) | 1.00(1.00~4.00) | 1.75(1.00~4.00) |
Tmax 为中位数(范围),t1/2 为算术平均值±SD,表中其余数据为几何平均值(%CV)
表4 中度肾功能不全和正常肾功能状态下先诺特韦药代动力学参数
| 参数 | 正常肾功能(N=6) | 中度肾功能不全(N=6) |
| AUC0-∞ (h·ng/mL) | 17639(26.8%) | 39105 (22.9%) |
| AUC0-t (h·ng/mL) | 17479(27.2%) | 38999 (23.0%) |
| Cmax(ng/mL) | 2977(28.8%) | 4820(18.8%) |
| t1/2 (h) | 3.90±0.602 | 4.26±0.679 |
| Tmax (h) | 1.50(0.50~2.00) | 2.24(1.50~3.97) |
Tmax 为中位数(范围),t1/2 为算术平均值±SD,表中其余数据为几何平均值(%CV)
肝损伤患者
尚未在重度肝功能不全受试者中开展临床研究。
单次空腹口服先诺特韦/利托那韦0.750g/0.1g后,与正常肝功能受试者相比,中度肝功能不全(Child Pugh B级)受试者先诺特韦的血浆蛋白结合率降低约9.1%,经血浆蛋白结合率校正后,先诺特韦的游离暴露量AUC0-t升高约3.3%,Cmax降低约14.3%。
表5 中度肝功能不全和正常肝功能状态下先诺特韦药代动力学参数
| 参数 | 正常肝功能(N=6) | 中度肝功能不全(N=6) | ||
| 血浆总暴露 | 血浆游离暴露 | 血浆总暴露 | 血浆游离暴露 | |
| AUC0-∞ (h·ng/mL) | 31687 (27.8%) | 11815(25.6%) | 26648 (25.5%) | 12207(39.9%) |
| AUC0-t (h·ng/mL) | 31611 (27.9%) | 11843(25.6%) | 26554 (25.5%) | 12251(39.9%) |
| Cmax(ng/mL) | 5374(22.8%) | 2009(22.5%) | 3744(24.1%) | 1721(40.4%) |
| t1/2 (h) | 5.01±1.61 | 3.56±0.495 | ||
| Tmax (h) | 2.00(1.50~3.00) | 1.75(0.50~4.00) | ||
Tmax 为中位数(范围),t1/2 为算术平均值±SD,表中其余数据为几何平均值(%CV)
【禁忌】
对本品中的活性成份或任何辅料过敏的患者禁用。
妊娠期间禁止使用本品。
本品不得与高度依赖 CYP3A 进行清除且其血浆浓度升高会导致严重和/或危及生命的不良反应的药物联用。本品不得与强效 CYP3A 诱导剂联用,否则会显著降低先诺特韦/利托那韦血浆浓度,可能导致病毒学应答丧失和潜在耐药性。鉴于CYP3A诱导剂停用后的延迟效应,即使最近停用了列在下表中的药物,也不能立即开始本品治疗。(见【药物相互作用】)。
表2 禁止与本品联用的药品
| 药品类别 | 此类药物中与本品配伍禁忌的药物 | 原理 |
| 合用药物水平升高或降低 | ||
| α1肾上腺素能受体拮抗剂 | 阿呋唑嗪 | 阿呋唑嗪的血药浓度增高,可能导致严重的低血压(参见【药物相互作用】)。 |
| 镇痛剂 | 哌替啶,吡罗昔康,丙氧芬 | 去甲哌替啶,吡罗昔康,丙氧芬的血药浓度增高。从而增加严重呼吸抑制、血液系统异常或这类药物所致的其它严重不良反应的发生风险。 |
| 抗心绞痛药 | 雷诺嗪 | 雷诺嗪的血浆浓度升高,可能使发生严重和/或危及生命的不良反应的可能性增加(参见【药物相互作用】)。 |
| 抗癌药 | Neratinib | Neratinib的血浆浓度升高,可能使发生严重和/或危及生命的不良反应如肝中毒的可能性增加(参见【药物相互作用】)。 |
| Venetoclax | Venetoclax的血药浓度增高。在起始剂量及剂量调整阶段肿瘤溶解综合征的风险增加(参见【药物相互作用】)。 | |
| 抗心律失常药 | 胺碘酮,苄普地尔,决奈达隆,恩卡尼,氟卡尼,普罗帕酮,奎尼丁 | 胺碘酮,苄普地尔,决奈达隆,恩卡尼,氟卡尼,普罗帕酮,奎尼丁的血药浓度增高。从而增加心律失常或这类药物所致的其它严重不良反应的发生风险。 |
| 抗生素 | 夫西地酸 | 夫西地酸和利托那韦的血药浓度增高。 |
| 抗真菌药 | 伏立康唑 | 利托那韦(400mg,一日两次和更多次)和伏立康唑禁止合用,因为会降低伏立康唑血药浓度,并可能导致失效(参见【药物相互作用】)。 |
| 抗组胺药 | 阿斯咪唑,特非那定 | 阿斯咪唑和特非那定的血药浓度增高。从而增加了这些药物所致严重心律失常的发生风险。 |
| 抗痛风药 | 秋水仙碱 | 对于有肝损伤、肾损伤患者具有严重不良反应或危及生命的潜在风险(参见【药物相互作用】)。 |
| 抗分枝杆菌药 | 利福布汀 | 利托那韦作为抗反转录病毒药(600mg,一日两次)和利福布汀合用会增加利福布汀的血清浓度和不良反应(包括葡萄膜炎)的发生风险(参见【注意事项】)。有关利托那韦作为药代动力学增强剂与利福布汀合用的建议参见【药物相互作用】。 |
| 抗精神病药/精神安定药 | 鲁拉西酮 | 鲁拉西酮的血浆浓度升高,可能使发生严重和/或危及生命的不良反应的可能性增加(参见【药物相互作用】)。 |
| 氯氮平,匹莫齐特 | 氯氮平和匹莫齐特的血药浓度增高。从而增加了严重血液学异常或这类药物所致的其它严重不良反应的发生风险。 | |
| 喹硫平 | 喹硫平血药浓度增高,从而导致昏迷。禁止与喹硫平联合用药。(参见【药物相互作用】) | |
| 麦角衍生物 | 二氢麦角胺,麦角新碱,麦角胺,甲基麦角新碱 | 麦角衍生物血药浓度的增高会导致急性麦角碱毒性,包括血管痉挛和缺血。 |
| 胃肠动力药 | 西沙必利 | 西沙必利的血药浓度增高。将增加该药所致严重心律失常的发生风险。 |
| 血脂调节剂:HMG-CoA 还原酶抑制剂 微粒体甘油三酯转运蛋白(MTTP) 抑制剂 |
洛伐他汀,辛伐他汀 Lomitapide |
洛伐他汀和辛伐他汀的血药浓度升高;因此增加了包括横纹肌溶解在内的肌病的发生风险。 Lomitapide 的血药浓度升高(参见【药物相互作用】)。 |
| PDE5 抑制剂 | 阿伐那非 | 阿伐那非的血药浓度升高(参见【注意事项】和【药物相互作用】)。 |
| 西地那非 | 当作为治疗肺动脉高压(PAH)药物时禁用。西地那非的血药浓度增高,会增加潜在的西地那非相关不良事件(包括低血压和晕厥)的发生风险。在勃起功能障碍患者中与西地那非合用参见【注意事项】和【药物相互作用】。 | |
| 伐地那非 | 伐地那非的血药浓度升高(参见【注意事项】和【药物相互作用】)。 | |
| 镇静/催眠药 | 氯拉卓酸,地西泮,舒乐安定,氟西泮,口服咪达唑仑和三唑仑 | 氯拉卓酸,地西泮,舒乐安定,氟西泮,口服咪达唑仑和三唑仑的血药浓度增高,从而增加了这些药物所致过度镇静和呼吸抑制的风险(参见【药物相互作用】)。 |
| 钙通道拮抗剂 | 贝尼地平、乐卡地平、氨氯地平、非洛地平、拉西地平、尼索地平 | 贝尼地平、乐卡地平、氨氯地平、非洛地平、拉西地平、尼索地平的血浆浓度升高,可能使发生严重的不良反应如严重低血压的可能性增加(参见【药物相互作用】)。 |
| 先诺特韦/利托那韦水平降低 | ||
| 中草药制剂 | 圣约翰草(贯叶连翘) | 由于有降低利托那韦的血药浓度和临床疗效的风险,禁止与含有圣约翰草(贯叶连翘)的中草药制剂合用(参见【药物相互作用】)。 |
| 抗感染药 | 利福平 | 利福平是CYP3A4强效诱导剂,合用后使先诺特韦/利托那韦的暴露减少,可能会导致病毒学反应的潜在丧失。(参见【药物相互作用】)。 |
| 抗惊厥药 | 卡马西平、苯妥英 | 卡马西平、苯妥英是强CYP3A4诱导剂,这可能导致先诺特韦/利托那韦的暴露减少和病毒学反应的潜在丧失。 |
【贮藏】
密封,不超过30℃保存。
请将本品放在儿童不能接触的地方。
【包装】
聚酰胺/铝/聚氯乙烯冷冲压成型固体药用复合硬片和药用铝箔包装,每板含先诺特韦片(粉红色)4片和利托那韦片(白色)2片。5板/盒。
【有效期】
24个月
【执行标准】
YBH01232023
【批准文号】
国药准字H20230001
【上市许可持有人】
名 称:海南先声药业有限公司
注册地址:海南省海口市秀英区药谷三路2号
邮政编码:570311
电话号码:0898-66814532
客户服务热线:
400-8877552(手机、固定电话均可拨打,按市话收费。)
传真号码:0898-66814239
网 址:www.simcere.com
【生产企业】
先诺特韦片/利托那韦片组合包装
企业名称:先声药业有限公司
生产地址:江苏省南京江北新区华康路99号
电话:025-58286999
传真:025-58285555
企业名称:海南先声药业有限公司
生产地址:海南省海口市秀英区药谷三路2号
电话:0898-66814532
传真:0898-66814239
组合包装中先诺特韦片
企业名称:先声药业有限公司
生产地址:江苏省南京江北新区华康路99号
电话:025-58286999
传真:025-58285555
企业名称:海南先声药业有限公司
生产地址:海南省海口市秀英区药谷三路2号
电话:0898-66814532
传真:0898-66814239
组合包装中利托那韦片
企业名称:广州玻思韬控释药业有限公司
生产地址:广州市黄埔区瑞祥路228号
电话:020-22017907
传真:020-22017917
企业名称:海南先声药业有限公司
生产地址:海南省海口市秀英区药谷三路2号
电话:0898-66814532
传真:0898-66814239
 苏公网安备 32010202010345号
苏公网安备 32010202010345号